¿Te has encontrado con un ácido clorhídrico (HCl) comercial sin etiqueta de concentración? En esta guía detallada, aprenderás a determinar con precisión la concentración de HCl mediante titulación. Este método es crucial para laboratorios, industrias químicas y estudiantes avanzados de química.
Recomendaciones de seguridad: Antes de comenzar, es crucial usar equipo de protección personal:
- Gafas de seguridad
- Guantes de laboratorio
- Tener en cuenta que el ácido clorhídrico e hidróxido de sodio son compuestos corrosivos
Materiales necesarios:
- Ácido clorhídrico comercial (sin concentración conocida)
- Hidróxido de sodio (NaOH) en hojuelas o polvo
- 5 mL de agua destilada
- Fenolftaleína al 1% en isopropanol
- Equipo de seguridad (gafas y guantes)
- Balanza analítica (precisión de 0.01 g)
- Probeta de 10 mL
- Matraz Erlenmeyer de 250 mL
- Pipeta graduada o bureta
- Termómetro (rango 0-100°C)
Paso 1: Preparación de la solución de hidróxido de sodio
Medición de reactivos:
- Pesar 2.00 gramos de hidróxido de sodio (NaOH).
- Medir 5 mL de agua destilada en una probeta.
Preparación de la solución:
- Mezclar cuidadosamente el NaOH con los 5 mL de agua destilada.
Cálculo de la molaridad:
(1) ![]()
(2) 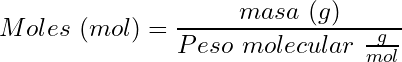
(3) 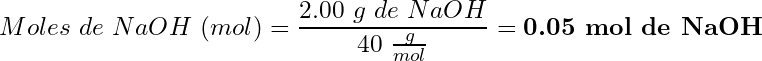
(4) 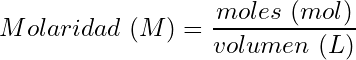
(5) 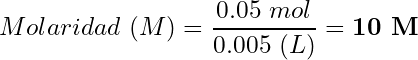
Resultado: Solución de NaOH 10 molar (10 M)
Nota: Se observará un aumento de temperatura debido a la reacción exotérmica. La temperatura puede subir hasta 40°C. El pH de esta solución es aproximadamente 11.
Paso 2: Preparación del ácido clorhídrico (HCl) para titulación
Medición del ácido:
- Medir 5 mL del ácido clorhídrico comercial usando una probeta de 10 mL.
- Verter cuidadosamente con la ayuda de un embudo los 5 mL de ácido en un matraz Erlenmeyer de 250 mL.
Adición del indicador:
- Agregar exactamente dos gotas de fenolftaleína en isopropanol al 1% m/m al matraz con el ácido.
- Mezclar suavemente para distribuir el indicador.
- Observar que la solución permanece incolora en este punto debido a que el pH del ácido es inferior a 7.
Paso 3: Proceso de titulación
Montaje del equipo:
- Preparar la pipeta graduada o bureta con la solución de NaOH 10M.
- Agregar gota a gota la solución de NaOH al ácido con la fenolftaleína.
- Agitar constantemente el matraz durante la adición.
- Continuar la adición hasta que la solución en el matraz se torne rosa fucsia.
- Este cambio de color indica el punto de neutralización HCl + NaOH → NaCl + H₂O
Medición del volumen:
- Anotar el volumen de NaOH utilizado. En este caso fue de 2.28 mL o 0.00228 L.
Paso 4: Cálculos
- Moles de NaOH usados:
(6)
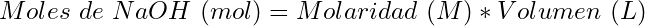
(7)
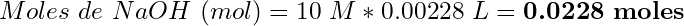
- La relación molar HCl:NaOH es 1:1, por lo tanto:
(8)
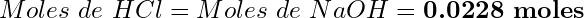
- Molaridad de HCl:
(9)
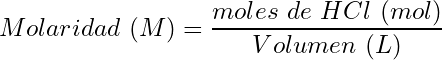
(10)
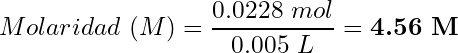
- Porcentaje masa/volumen:
(11)
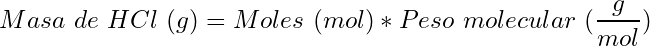
(12)
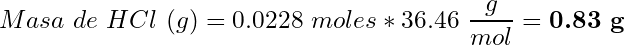
(13)
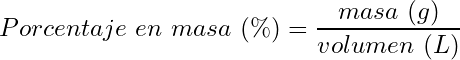
(14)
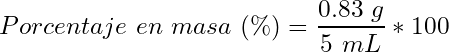
(15)
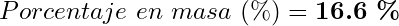
Resultado: El HCl comercial tiene una concentración de 4.56 M o 16.6% m/v (% g de HCl/mL).
Nota: El pH final de la solución titulada es aproximadamente 12, lo que indica un ligero exceso de base.
Paso 5. Etiquetado:
- Marcar la botella con la concentración determinada, expresada tanto en términos de molaridad (M) como en porcentaje masa/volumen (% m/v).
Recomendación adicional:
Para mayor precisión, considera realizar una segunda titulación.
Este etiquetado preciso no solo facilita el uso futuro del ácido en experimentos y procesos químicos, sino que también cumple con las normas de seguridad y buenas prácticas de laboratorio. Es importante asegurarse de que la etiqueta sea resistente a los químicos, claramente legible y contenga toda la información relevante, incluyendo la fecha de la determinación de la concentración. Este proceso de etiquetado meticuloso ayuda a prevenir errores, optimiza el manejo de reactivos y contribuye a mantener un ambiente de trabajo seguro y eficiente en el laboratorio.